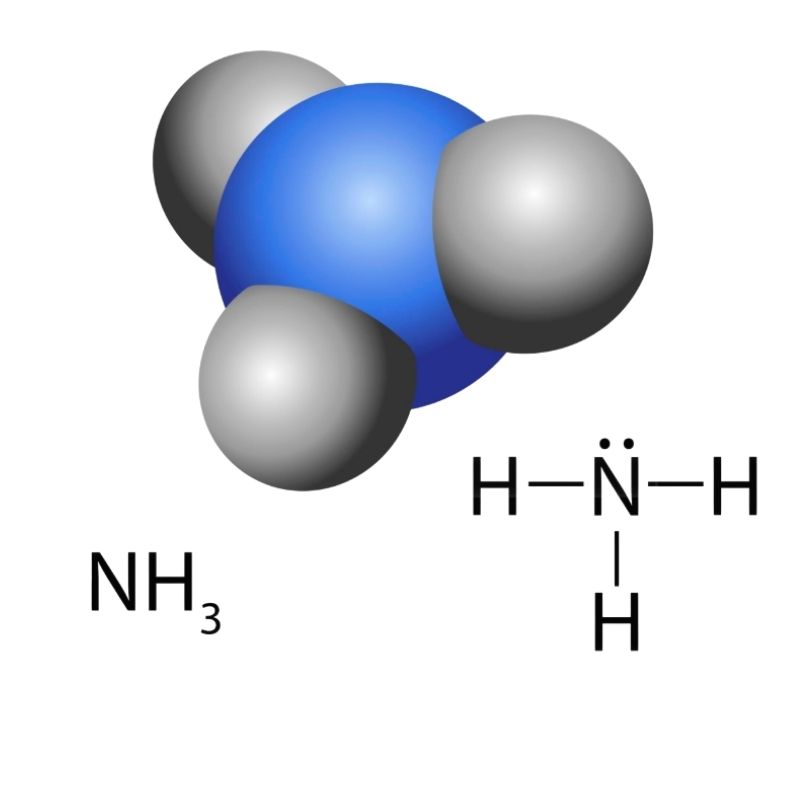
Asit Baz Tepkimesi Nedir?
Asit baz tepkimeleri, asit ve bazın iyon alışverişi sonucu tuz ve su oluşturduğu reaksiyonlardır.
- Asitten gelen H₃O⁺ iyonları ve bazdan gelen OH⁻ iyonları birleşir.
- Ortamdaki çözeltinin pH’ı nötrleşir.
- Bu olaya nötralleşme tepkimesi denir.
Kısaca: Asit + Baz → Tuz + Su
Asitle Baz Tepkimeye Girerse Ne Olur?
- Ortada tuz ve su oluşur.
- H değeri yaklaşık 7’ye yaklaşır.
- Çözeltide genellikle ısı açığa çıkar.
Asit Baz Özellikleri
Asit ve bazlar, kimyasal özellikleri açısından birbirinden oldukça farklıdır. Bu özellikler hem laboratuvar deneylerinde hem de günlük hayatta maddelerin davranışını anlamamıza yardımcı olur.
Asitlerin Özellikleri:
- Tatları ekşidir (ör: limon, sirke).
- Turnusol kâğıdını kırmızıya çevirir.
- Sulu çözeltileri elektriği iletir (iyonlara ayrılırlar).
- Metal ile tepkimeye girerek hidrojen gazı çıkarır.
- pH değerleri 7’den küçüktür.
Bazların Özellikleri:
- Tatları acıdır ve kaygan bir his verir.
- Turnusol kâğıdını maviye çevirir.
- Sulu çözeltileri elektriği iletir.
- Asitlerle birleşerek tuz ve su oluşturur.
- pH değerleri 7’den büyüktür.
Asit-Baz Tepkimeleri Endotermik mi?
Asit-baz tepkimeleri genellikle ekzotermiktir, yani ısı açığa çıkar. Bu nedenle tepkime sırasında ortam biraz ısınır. Endüstride ve laboratuvarlarda bu özellik, reaksiyonun verimliliğini ölçmek için önemlidir.
Asit ve Bazlar Örnekler
Asit Örnekleri:
- Hidroklorik asit (HCl) – Mide asidi, laboratuvar kullanımı.
- Sülfürik asit (H₂SO₄) – Akü asidi, endüstride kullanılır.
- Nitrik asit (HNO₃) – Gübre ve patlayıcı üretiminde kullanılır.
- Asetik asit (CH₃COOH) – Sirke ve gıda sektöründe kullanılır.
Baz Örnekleri:
- Sodyum hidroksit (NaOH) – Sabun ve deterjan üretiminde kullanılır.
- Potasyum hidroksit (KOH) – Endüstride ve pil üretiminde kullanılır.
- Kalsiyum hidroksit (Ca(OH)₂) – İnşaat ve tarımda kullanılır.
- Amonyak (NH₃) – Temizlik ürünlerinde yaygın bir bazdır.
Günlük Hayatta Asit Baz Örnekleri
- Sirke – Asidiktir, yemeklerde ve temizlikte kullanılır.
- Limon – Sitrik asit içerir, ekşi tadı verir.
- Sabun – Baziktir, yağ ve kirleri çözerek temizlik sağlar.
- Çamaşır suyu – Bazik özellik taşır, dezenfeksiyon ve temizlikte kullanılır.
- Gazlı içecekler – Karbonik asit içerir, ekşi tadı ve gazı sağlar.
Metal + Asit Tepkimeleri Örnekleri
Metaller asitlerle tepkimeye girerek tuz ve hidrojen gazı oluşturur.
Örnek Denklem:
Zn + 2HCl → ZnCl₂ + H₂
Bu tepkime, laboratuvar deneylerinde ve endüstride metallerin temizlenmesi veya gaz üretimi için kullanılır.
Asit ve Baz Elektriği İletir mi?
Evet, asit ve bazların sulu çözeltileri elektriği iletir. Çözelti içindeki serbest iyonlar, elektrik akımının geçmesini sağlar ve bu çözeltiler elektrolit olarak adlandırılır.
Asit ve Baz Tepkimeleri Nelerdir?
En temel asit-baz tepkimesi nötralleşme tepkimesidir:
Asit + Baz → Tuz + Su
Örnek: HCl + NaOH → NaCl + H₂O
Bir Tepkimenin Asit mi Baz mı Olduğunu Nasıl Anlarız?
- Turnusol kâğıdı testi: Kırmızıya dönerse asit, maviye dönerse bazdır.
- pH ölçümü: 7’den küçükse asit, büyükse bazdır.
- Tat ve dokunma: Asitler ekşi, bazlar kaygandır (dokunmak tehlikeli olabilir).
Asit Baz Tepkimelerinde Ne Açığa Çıkar?
- Tuz
- Su (H₂O)
- Isı
Bu nedenle asit-baz tepkimeleri genellikle ekzotermiktir.