Kezzap Formülü
Kezzap olarak bilinen nitrik asit, güçlü aşındırıcı ve korozif özelliklere sahip, renksiz (bekledikçe sararan) bir inorganik asittir. Kimyasal formülü HNO3 olan bu bileşik; bir hidrojen, bir azot ve üç oksijen atomundan oluşur. Sanayide gübre ve patlayıcı üretiminden metal işlemeye kadar geniş bir alanda kullanılan kezzap, proteinlerle temas ettiğinde cildi sarıya boyayan ve ciddi doku yanıklarına yol açan çok tehlikeli bir maddedir.
Kezzap Nedir?
Kezzap, kimyasal adıyla Nitrik asit, formülü HNO₃ olan güçlü ve aşındırıcı bir mineral asittir. Renksiz ya da hafif sarı renkte sıvı halde bulunur ve yüksek derecede yakıcı özelliğe sahiptir.
Kezzap olarak bilinen nitrik asit, kuvvetli asitler grubunda yer alır ve özellikle oksitleyici özelliği ile dikkat çeker. Bu özelliği sayesinde birçok metal ve organik madde ile reaksiyona girebilir. Kimyasal yapısı gereği oldukça reaktif bir maddedir ve temas ettiği yüzeylerde aşındırıcı etki gösterir.
Nitrik asit, doğada serbest halde bulunmaz; genellikle endüstriyel üretimle elde edilir. Saf hali renksizdir ancak zamanla azot dioksit gazı oluşumu nedeniyle sarımsı bir renk alabilir. Yoğun buharı ve keskin kokusu vardır.
Kezzap Yaygın Adı Nedir?
Kezzap, halk arasında kullanılan bir isimdir ve bu maddenin yaygın (bilimsel) adı Nitrik Asittir. Kimya literatüründe ve resmi kaynaklarda “kezzap” değil, “nitrik asit” ifadesi kullanılır.
Günlük dilde özellikle güçlü temizlik maddeleri veya aşındırıcı asitler için “kezzap” kelimesi tercih edilir. Ancak teknik, akademik ve endüstriyel alanlarda doğru ve geçerli isim nitrik asittir. Bu nedenle ürün etiketlerinde, güvenlik bilgi formlarında ve kimyasal belgelerde genellikle “HNO₃ (Nitrik Asit)” şeklinde yer alır.
Özetle; kezzap ve nitrik asit aynı maddeyi ifade eder. “Kezzap” yaygın halk adıdır, “Nitrik Asit” ise bilimsel ve resmi adıdır.
Nitrik Asit Kimyasal Formülü Nedir?
Nitrik asit, halk arasında kezzap olarak bilinen kuvvetli bir asittir. Kimyasal formülü HNO₃ şeklindedir ve bu formül, molekülün bir hidrojen (H), bir azot (N) ve üç oksijen (O) atomundan oluştuğunu gösterir.
Formülün anlamı şunlardır:
- H: Hidrojen atomu, asit özelliğini gösterir.
- N: Azot atomu, molekülün merkezinde bulunur.
- O₃: Üç oksijen atomu, güçlü oksitleyici özelliği sağlar.
Nitrik asidin moleküler yapısı nedeniyle oldukça reaktif olduğu ve metal ve organik maddelerle kolay reaksiyona girdiği bilinir. Bu nedenle formülünü bilmek, hem laboratuvar hem endüstriyel kullanımda önemlidir.
Nitrik Asit Özellikleri Nelerdir?
Nitrik asit (kezzap), kuvvetli bir mineral asittir ve hem fiziksel hem kimyasal özellikleri ile dikkat çeker.
- Görünüm: Saf halde renksiz, zamanla sarımsı olabilen bir sıvıdır.
- Koku: Keskin ve boğucu bir kokuya sahiptir.
- Asitlik: Kuvvetli bir asittir, hidrojen iyonu (H⁺) yoğunluğu yüksektir.
- Oksitleyici özellik: Organik ve metalik maddeleri oksitleyebilir.
- Çözünürlük: Su ile kolayca karışır, fakat karıştırırken ısı açığa çıkar.
- Yoğunluk: Yaklaşık 1,51 g/cm³ (konsantre çözeltide).
- Tehlike: Cilt ve gözle temasında ciddi yanıklara yol açar; solunması zararlıdır.
Dumanlı Nitrik Asit Nedir?
Dumanlı nitrik asit, konsantre nitrik asidin havayla temas ettiğinde ortaya çıkan ve gözle görülebilen sarı-turuncu renkte dumanlara sahip çözeltisidir. Bu duman, nitrik asidin oksitlenmiş nitrojen gazları (NO₂) ile reaksiyona girmesinden kaynaklanır ve bu özelliği ile hem tehlikeli hem de karakteristiktir.
Özellikleri ve dikkat edilmesi gerekenler:
- Renk ve görünüm: Saf nitrik asit renksizdir, ancak dumanlı formu sarı-turuncu görünür.
- Koku: Keskin ve boğucu bir kokuya sahiptir; solunması sağlığa zararlıdır.
- Reaktivite: Metal ve organik maddelerle temas ettiğinde aşındırıcı etki gösterir.
- Havayla tepkime: NO₂ gazı oluşturarak duman çıkarır ve toksik olabilir.
- Kullanım: Genellikle laboratuvar ve endüstriyel analizlerde dikkatle kullanılır.
Dumanlı nitrik asit, güvenli ortamda, iyi havalandırılan laboratuvarlarda ve koruyucu ekipmanlarla kullanılmalıdır. Bu dumanın solunması akciğer ve göz sağlığı için ciddi riskler taşır.
Susuz Nitrik Asit Nedir?
Susuz nitrik asit, içinde su bulunmayan, yüksek saflığa sahip ve güçlü asidik özellik gösteren nitrik asit formudur. “Anhidrit nitrik asit” olarak da adlandırılır ve laboratuvar ortamında özel reaksiyonlar için kullanılır.
Özellikleri:
- Yüksek saflık: Su içermediği için reaksiyonlarda daha kontrollü davranır.
- Yoğun asidik etki: Su ile seyreltildiğinde şiddetli reaksiyon gösterir.
- Reaktivite: Organik ve metalik maddelerle temasında aşındırıcıdır.
- Depolama: Susuz ortamda, cam veya özel plastik kaplarda muhafaza edilir.
- Tehlike: Çok güçlü ve yakıcıdır; ciltle temas ve solunması tehlikelidir.
Susuz nitrik asit, özellikle nitro bileşiklerin sentezinde ve bazı laboratuvar deneylerinde kullanılır. Seyreltme veya suyla karıştırma işlemi mutlaka kontrollü yapılmalıdır.
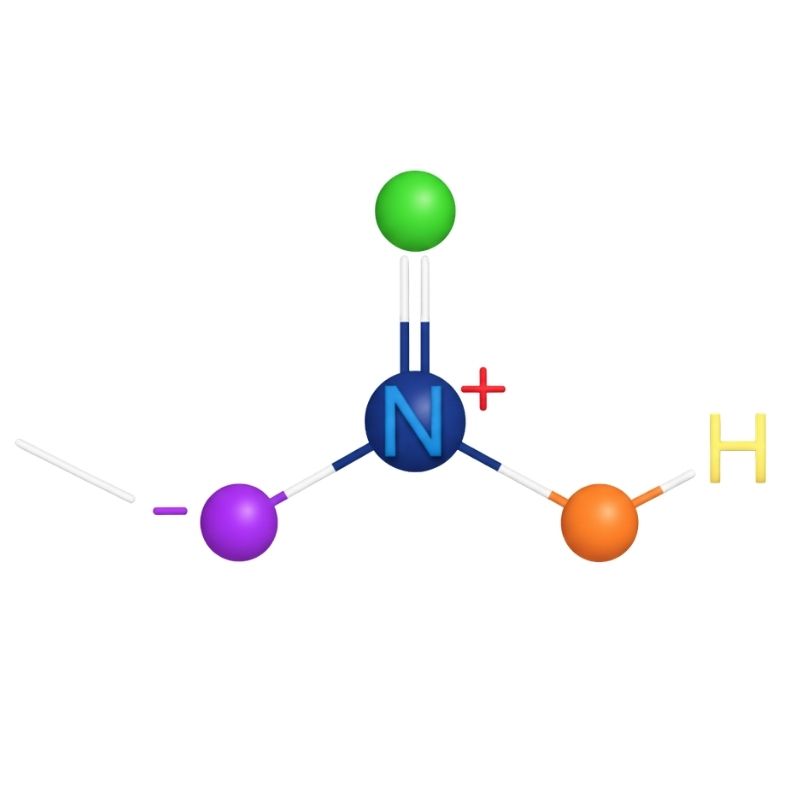
Nitrik Asit Yapısı ve Bağlanma Özellikleri
Nitrik asit (HNO₃), bir hidrojen (H), bir azot (N) ve üç oksijen (O) atomundan oluşan güçlü bir asittir. Molekül yapısı trigonal düzlemsel olup, azot atomu merkezde bulunur ve oksijenlerle bağlanmıştır.
Detaylı özellikler:
- Bağ türleri: Nitrik asitte bir N–O tek bağı ve iki N=O çift bağı bulunur. Bu yapı moleküle oksitleyici özellik kazandırır.
- Moleküler geometri: Trigonal düzlemsel yapı sayesinde elektron yoğunluğu eşit dağılır.
- Hidrojen bağı: H atomu, suyla veya diğer polar moleküllerle güçlü hidrojen bağları oluşturabilir.
- Reaktivite: Bu yapı nitrik asidin metal ve organik maddelerle yüksek oranda reaksiyona girmesini sağlar.
- Oksitleyici özellik: Moleküldeki çift bağlar, organik ve inorganik maddeleri oksitleme kapasitesini artırır.
Nitrik asidin yapısı ve bağlanma özellikleri, hem laboratuvar hem endüstriyel kullanımlarda reaktivite ve tehlike seviyesini belirler. Bu nedenle molekülün yapısı iyi anlaşılmalıdır.
Nitrik Asidin Temel Reaksiyonları Nelerdir?
Nitrik asit (kezzap), kuvvetli bir asit ve oksitleyici olduğundan çok çeşitli kimyasal reaksiyonlarda kullanılır. Temel reaksiyonları şunlardır:
- Metal Reaksiyonları: Bakır, çinko ve demir gibi metallerle reaksiyona girerek nitrat tuzları ve hidrojen gazı oluşturur.
- Oksitleme Reaksiyonları: Organik bileşikleri oksitleyerek nitro bileşikler üretir. Örnek: Nitrogliserin ve TNT üretimi.
- Asit-Baz Reaksiyonları: Kuvvetli bazlarla nötrleşme reaksiyonu verir, tuz ve su oluşur.
- Redoks Reaksiyonları: NO₂ ve diğer azot oksitleri açığa çıkararak elektron transferi sağlar.
- Karışım Reaksiyonları: Sulfurik asit ile karıştırıldığında “karışık asit” oluşur ve nitrasyon reaksiyonlarında kullanılır.
Bu reaksiyonlar nitrik asidin endüstriyel, laboratuvar ve kimyasal sentezlerde vazgeçilmez olmasını sağlar. Ancak tehlikeli olduğu için tüm reaksiyonlar kontrollü ortamda yapılmalıdır.
Nitrik Asit pH Değeri Kaçtır?
Nitrik asit, kuvvetli bir asit olduğu için pH değeri oldukça düşüktür. Konsantre nitrik asit çözeltisinin pH değeri yaklaşık 0–1 civarındadır.
pH değeri düşük olduğu için:
- Metal yüzeylerle temasında aşındırıcı etki yapar.
- Cilt ve gözle temasında ciddi yanıklara neden olabilir.
- Çevreye dökülmesi durumunda toprak ve su kirliliğine yol açabilir.
Seyreltildiğinde pH yükselir ancak hâlâ güçlü asit özelliğini korur.
Kezzap Asit mi Baz mı?
Kezzap, yani nitrik asit, kuvvetli bir asittir. Baz özelliği yoktur ve hidrojen iyonu (H⁺) veren bir maddedir.
- Hidrojen iyonu yoğunluğu yüksektir → asit karakterini gösterir.
- Metallerle reaksiyona girerek hidrojen gazı açığa çıkarabilir.
- pH değeri 1 civarında → güçlü asit olduğunu gösterir.
- Bazlarla karıştırıldığında nötrleşme reaksiyonu verir.
Özetle, kezzap hiçbir koşulda baz olarak sınıflandırılmaz, her zaman asit özelliği taşır.
Nitrik Asit Ne İşe Yarar?
Nitrik asit (kezzap), yüksek reaktivitesi ve oksitleyici özelliği sayesinde pek çok alanda kullanılır. Temel kullanım alanları şunlardır:
- Metal yüzeyleri temizleme ve parlatma işlemleri
- Gübre üretiminde azot kaynağı olarak kullanımı
- Patlayıcı ve kimyasal madde üretimi
- Laboratuvar analizlerinde reaktif olarak kullanımı
- Endüstriyel kimyasal üretim süreçlerinde oksitleyici ajan olarak görev alması
Bu kullanım alanları, nitrik asidin güçlü asit ve oksitleyici özelliklerinden kaynaklanır.
Nitrik Asit Nerelerde Kullanılır?
Nitrik asit, hem endüstriyel hem de laboratuvar ortamlarında yaygın olarak kullanılır. Başlıca kullanım alanları:
- Gübre sanayi: Amonyum nitrat üretiminde kullanılır.
- Patlayıcı üretimi: TNT ve nitrogliserin gibi patlayıcıların yapımında kullanılır.
- Metal işlemleri: Metal yüzey temizleme ve parlatma işlemlerinde uygulanır.
- Laboratuvar çalışmaları: Analizlerde ve reaksiyonlarda reaktif olarak kullanılır.
- Endüstriyel kimya: Oksitleyici ajan olarak çeşitli kimyasal üretim süreçlerinde görev alır.
Kezzap ile Tuz Ruhu Aynı mı?
Hayır, kezzap ve tuz ruhu farklı maddelerdir:
- Kezzap: Kimyasal adı nitrik asit (HNO₃), kuvvetli asit ve oksitleyicidir.
- Tuz Ruhu: Kimyasal adı hidroklorik asit (HCl), güçlü asit ama oksitleyici özelliği yoktur.
Her ikisi de kuvvetli asit olmasına rağmen kimyasal yapıları ve kullanım alanları farklıdır. Karıştırılmamalıdır.
Kezzap Nasıl Elde Edilir?
Kezzap (nitrik asit), laboratuvar ve endüstriyel ortamlarda özel yöntemlerle üretilir. Temel üretim yöntemi şunlardır:
- Amonyum nitrat veya amonyum sülfat gibi azotlu maddelerin oksitlenmesi
- Hava veya oksijen ile amonyağın katalizör yardımıyla reaksiyona sokulması
- Reaksiyon sonucu ortaya çıkan azot dioksit gazının suyla çözündürülmesi
- Saflaştırma işlemi ile HNO₃ elde edilmesi
Ev ortamında üretimi tehlikelidir ve yasalarca sınırlıdır. Profesyonel ortamda, kontrollü şartlarda yapılması gerekir.
Nitrik Asit Kullanımında Dikkat Edilmesi Gerekenler Nelerdir?
Nitrik asit, çok güçlü bir asit olduğu için kullanım sırasında güvenlik önlemleri şarttır:
- Eldiven, gözlük ve koruyucu kıyafet kullanın.
- Solunum maskesi ile çalışın, buharını solumayın.
- Asidi suyla seyreltirken her zaman asidin suya eklenmesi gerekir, aksi durumda patlayıcı ısı açığa çıkar.
- Metaller ve organik maddelerle temas ettirmeyin, aşındırıcı etki gösterir.
- Çocuklardan ve evcil hayvanlardan uzak tutun.
- Depolama sırasında uygun kap ve ortam kullanın.
- Atıklarını çevreye zarar vermeden imha edin.
Bu kurallara uyulduğunda nitrik asit güvenli bir şekilde kullanılabilir.











